蛋白质
蛋白质(protein)和多肽均都由各种L-α-氨基酸残基通过肽键相连形成的多聚物,他们之间不存在绝对严格的分界线。
通常将相对分子质量在10kD以上(约100个左右氨基酸单位)且不能透过天然渗析膜、结构较复杂的多肽称为蛋白质,10kD以下的称为多肽。
从各种生物组织中提取的蛋白质经元素分析,发现含有碳、氢、氧、氮;大多数蛋白质还含有硫;有些蛋白质含有磷;少量蛋白质还含有微量金属元素如铁、铜、锌、锰等;个别蛋白质含有碘。
一、分子结构
各种蛋白质的特殊功能和活性不仅取决于多肽链的氨基酸组成、数目及排列顺序,还与其特定的空间构象密切相关。
常将蛋白质结构分为一级结构、二级结构、三级结构和四级结构。
蛋白质的一级结构又称为初级结构或基本结构,二级结构以上属于构象范畴,称为高级结构。
(一)一级结构
蛋白质分子的一级结构(primary structure)是指多肽链中氨基酸残基的排列顺序,肽键是一级结构中连接氨基酸残基的主要化学键。
任何特定的蛋白质都有其特定的氨基酸排列顺序,有些蛋白质分子只有一条多肽链,有的蛋白质分子则由两条或多条肽链构成。
蛋白质的一级结构是空间构象和特定生物学功能的基础。一级结构相似的多肽或蛋白质,其空间构象以及功能也相似。
胰岛素(insulin)相对分子质量约为6kD,应归为多肽,但在溶液中受金属离子(如Zn2+)的作用后迅速形成二聚体,因此胰岛素被认为是最小的一种蛋白质。
胰岛素(insulin)是由胰岛β细胞受内源性或外源性物质,如葡萄糖、乳糖、核糖、精氨酸、胰高血糖素等的刺激而分泌的一种蛋白质激素。胰岛素是体内唯一能降低血糖的物质,能够增强细胞对葡萄糖的摄取利用,保持血糖在正常范围,同时促进糖原、脂肪、蛋白质等的合成。
胰岛素由A、B两个肽链组成。人胰岛素A链有11种共21个氨基酸;B链则有15种共30个氨基酸。人胰岛素的A、B两个肽链共有16种51个氨基酸。
其中A7(Cys)-B7(Cys)、A20(Cys)-B19(Cys)四个半胱氨酸中的巯基形成两个-S-S-键,将A、B两链连接起来。此外A链中A6(Cys)与 A11(Cys)之间也存在一个-S-S-键。
若破坏A、B两链间的二硫键,胰岛素的生物活性则完全丧失。人胰岛素分子的一级结构如图17-4所示。
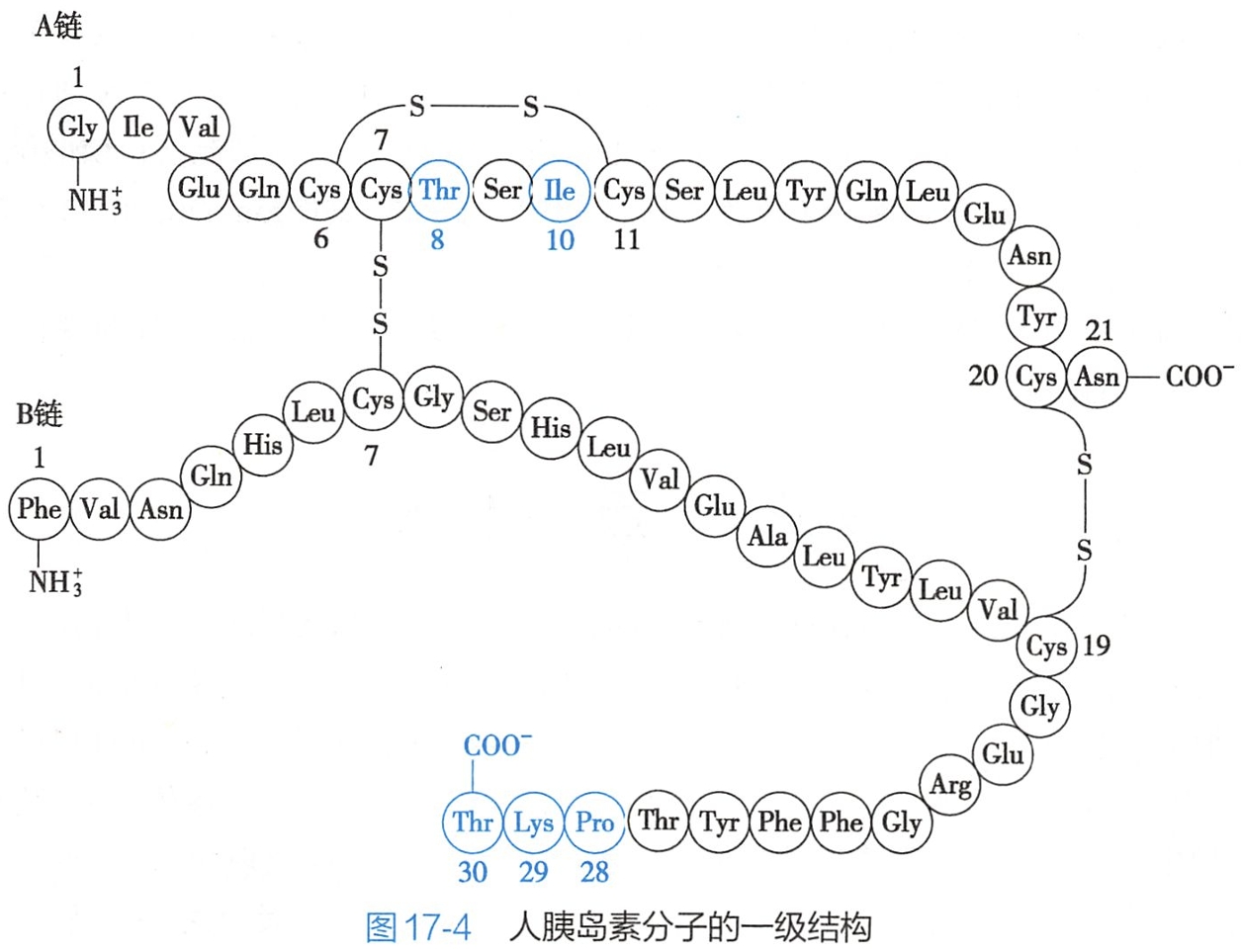
不同种属的胰岛素在氨基酸组成及顺序中稍有差异,如在人胰岛素和牛胰岛素中有3个氨基酸残基不同,而在人胰岛素与猪胰岛素中仅有1个氨基酸残基差异。个别氨基酸残基的变化不影响胰岛素的分子结构的形成和稳定,因而其功能是相同的。
糖尿病因胰岛素,无法利用葡萄糖,因此需要补充胰岛素。除了生物来源的猪胰岛素和牛胰岛素外,尚可通过基因工程生产人胰岛素。
甘精胰岛素(insulin glargine)、赖脯胰岛素(insulin lispro)及门冬胰岛素(insulin aspart),也是临床上治疗糖尿病的胰岛素类药物。
(二)空间结构
蛋白质空间结构是指多肽链在空间进一步盘曲折叠形成的构象,它包括二级结构、三级结构和四级结构。蛋白质的空间结构是蛋白质特有性质和功能的结构基础。
维系蛋白质构象稳定的主要因素是多肽链中各原子和原子团相互之间的作用力。
每一种蛋白质分子都有自己特有的氨基酸的排列顺序和组成,即一级结构。氨基酸排列顺序决定它的特定的空间结构,也就是蛋白质的一级结构决定了蛋白质的二级、三级等高级结构。
结构:
- 一级结构:氨基酸排列顺序
- 二级结构:借助氢键
- 三级结构:不同侧链相互作用,氢键、离子键、疏水键,可有生物活性,变性/复性
- 结构域:如螺旋-环-螺旋(HLH)、亮氨酸拉链(L-Zip),多为转录因子
- 四级结构:亚单位(独立肽链)相互作用,氢键等非共价键
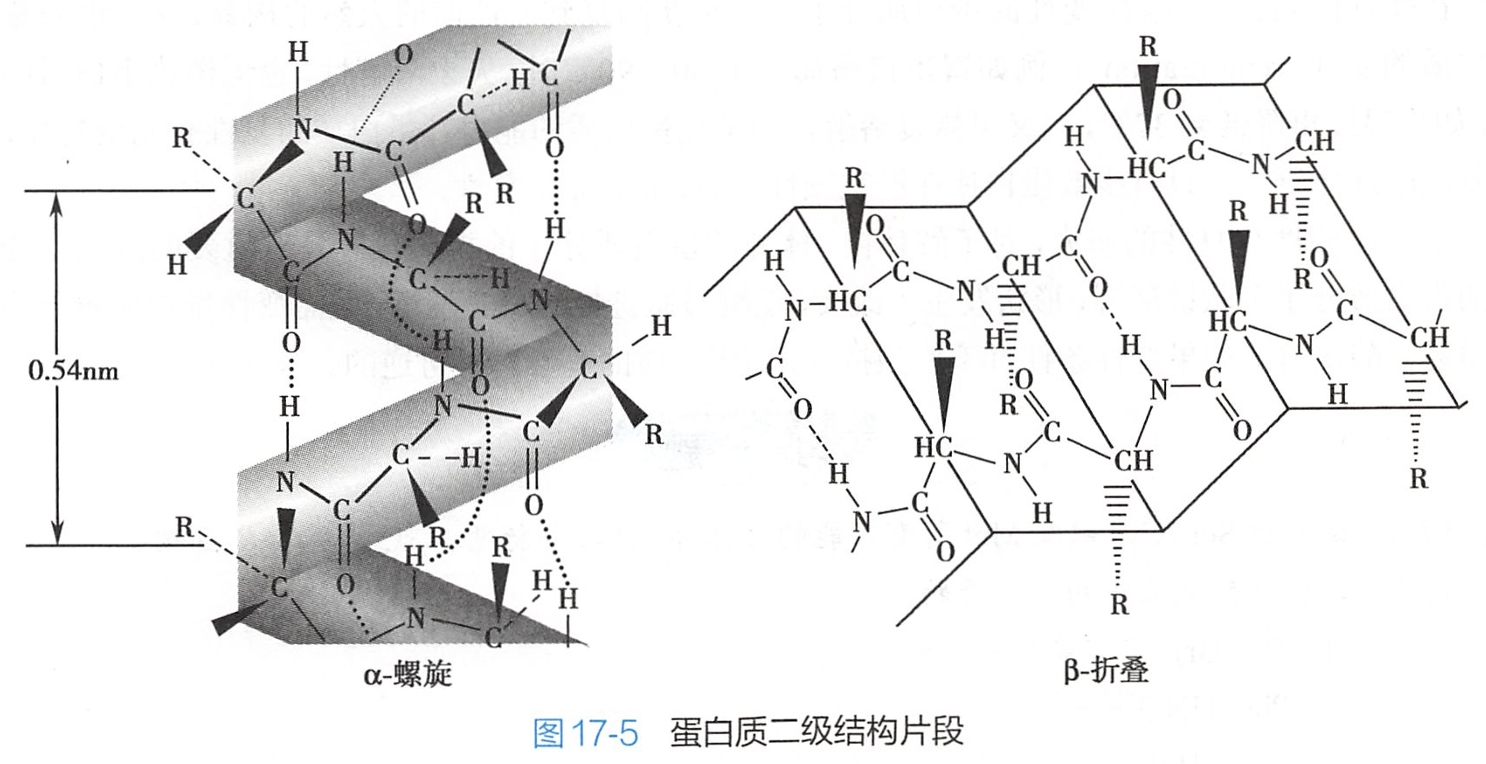
特定一级结构多肽链中各肽键平面通过α-碳原子的旋转形成的一定构象,称为二级结构。二级结构的形成,是借助一个肽键平面中的C=O和另一肽键平面中的-NH-之间形成的氢键使肽键平面呈现不同的卷曲和折叠形状,主要有a-螺旋(a-helix)和B-折叠层(B-pleated sheet)等(图17-5)。
二、性质
蛋白质是高分子化合物,相对分子质量大,其分子颗粒的直径一般在1~100nm之间,属于胶体分散系,因此蛋白质具有胶体溶液的特性。如布朗运动、丁泽尔效应、不能透过半透膜以及具有吸附性质等。
蛋白质分子末端仍具有游离的氨基和羧基,同时组成肽链的氨基酸残基侧链上还含有不同数量可解离的基团:如赖氨酸的氨基、精氨酸的胍基、组氨酸的咪唑基、谷氨酸的羧基。因此,蛋白质和氨基酸一样,也具有两性解离和等电点的性质。
当蛋白质所带的正、负电荷数相等时,净电荷为零,此时溶液的pH值为蛋白质的等电点(pI)。在等电状态时,不存在电荷相互排斥作用,蛋白质颗粒易聚积而沉淀析出,此时蛋白质的溶解度、黏度、渗透压、膨胀性等都最小。由于蛋白质的两性解离和等电点的特性,它与氨基酸一样也可采用电泳技术进行分离和纯化。
天然蛋白质因受物理因素(如加热、高压、紫外线、X-射线)或化学因素(如强酸、强碱、尿素、重金属盐、三氯乙酸等)的影响,分子的肽链虽不裂解,但可改变或破坏蛋白质分子空间结构,从而导致蛋白质生物活性的丧失和其他的物理、化学性质的变化,这种现象称为蛋白质的变性(denaturation)。
变性后的蛋白质分子多肽链展开,形状发生了改变,使酶与肽键接触机会增多,因而变性蛋白质较天然蛋白质易被酶水解。如果变性条件过于剧烈持久,则蛋白质的变性是不可逆的。
蛋白质的变性主要为二硫键和非共价键的破坏,从而发生空间构象的破坏,并不涉及一级结构的改变。蛋白质的变性常伴随有下列现象:
- 生物活性丧失。这是蛋白质变性的最主要特征。
- 化学性质的改变。
- 物理性质的改变,如溶解度降低、黏度增加、结晶能力消失。
蛋白质变性在实际应用上具有重要意义。临床上常用高温、紫外线和酒精等物理或化学方法进行消毒,促使细菌或病毒的蛋白质变性而失去致病及繁殖能力。临床上急救重金属盐中毒病人,常先服用大量牛奶和蛋清,使蛋白质在消化道中与重金属盐结合成变性蛋白,从而阻止有毒重金属离子被人体吸收。
在变性因素去除以后,变性的蛋白质分子又可重新回复到变性前的天然的构象,这一现象称为蛋白质的复性(renaturation)。例如胃蛋白酶加热至80~90℃时,失去溶解性,也无消化蛋白质的能力,如将温度再降低到37℃,则又可恢复溶解性和消化蛋白质的能力。
蛋白质的复性有完全复性、基本复性或部分复性。只有少数蛋白质在严重变性以后,能够完全复性。